がん治療別
化学療法による卵巣毒性のメカニズム
化学療法による卵巣毒性のメカニズム

化学療法は抗がん剤の内服や注射によって全身に広がる可能性のあるがん細胞や、すでに他の場所へ転移していたり、全身に広がっていたりするがん細胞を攻撃するものです。正常な細胞は一定の規律をもって成長し、死んでいきます。ところががん細胞は分裂をいつまでも続け、無秩序に増え続けます。抗がん剤は、がん細胞の細胞分裂過程に働き、がん細胞の増殖を抑制、がん細胞の死滅を促します。
がんの種類によっては、第一選択の治療法として化学療法を行うことがあり、また、手術や放射線と組み合わせて補助的に化学療法を行うことや、がんを小さくするために手術の前に化学療法を行うこともあります。化学療法では、がん細胞の増殖を抑える一方で、正常な細胞にも影響を与え、副作用をきたします。特に、細胞分裂の活発な細胞、血液細胞、胃腸粘膜、毛根の細胞などが影響を受けますが、生殖細胞も影響を受けます。抗がん剤投与によって、卵巣にダメージが加わると、無月経や閉経を起こします。抗がん剤の種類・量・患者さんの年齢によって卵巣における障害の程度は異なり、卵巣毒性のリスクが異なります。
抗がん剤による卵巣機能への影響の原因は、抗がん剤等による発育卵胞への影響と卵子の枯渇という二つのメカニズムが考えられています。卵巣では、原始卵胞と呼ばれる卵子の元から、月経周期に合わせて一定数の卵胞が発育し、最終的に一つの卵子が排卵されます。発育段階の卵胞が影響を受ける場合、抗がん剤投与によって、卵子自体や卵子を取り囲んでいる顆粒膜細胞にアポトーシスとよばれる細胞死が引き起こされます。また、卵巣の周りの血管が途絶え、卵巣の周囲に線維化が起こり、卵巣への血流が減ることで、発育卵胞に影響を与えられると考えられています。
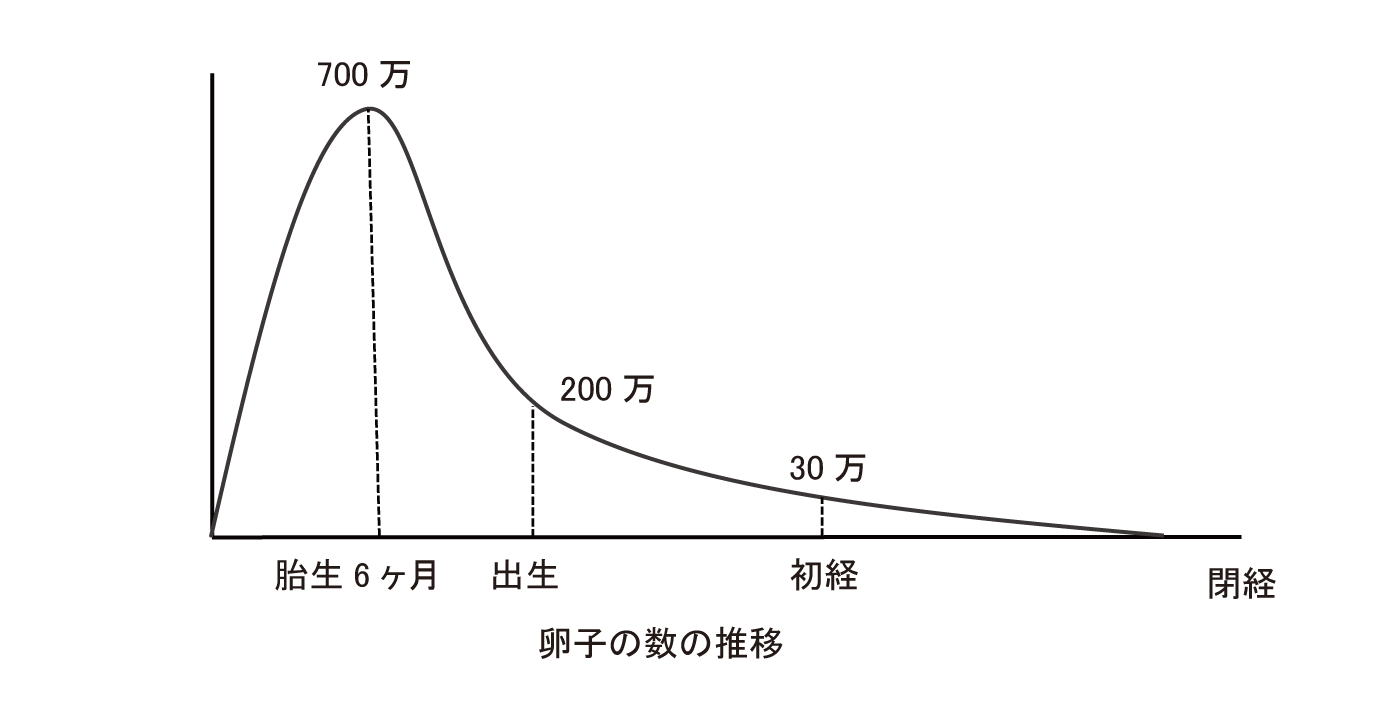
一方で、抗がん剤投与によって卵子の数が通常よりも早く減少することが知られています。卵子の元である原始卵胞は胎児期には最大で700万個ありますが、それ以降は減少し、増えることはありません。出生時には200万個、初経のころには20万個、1,000個未満になると閉経を迎えるといわれています(図1)。抗がん剤の投与によって、原始卵胞の卵子がDNA損傷を受け、細胞死に至り、卵子の数が減少します。
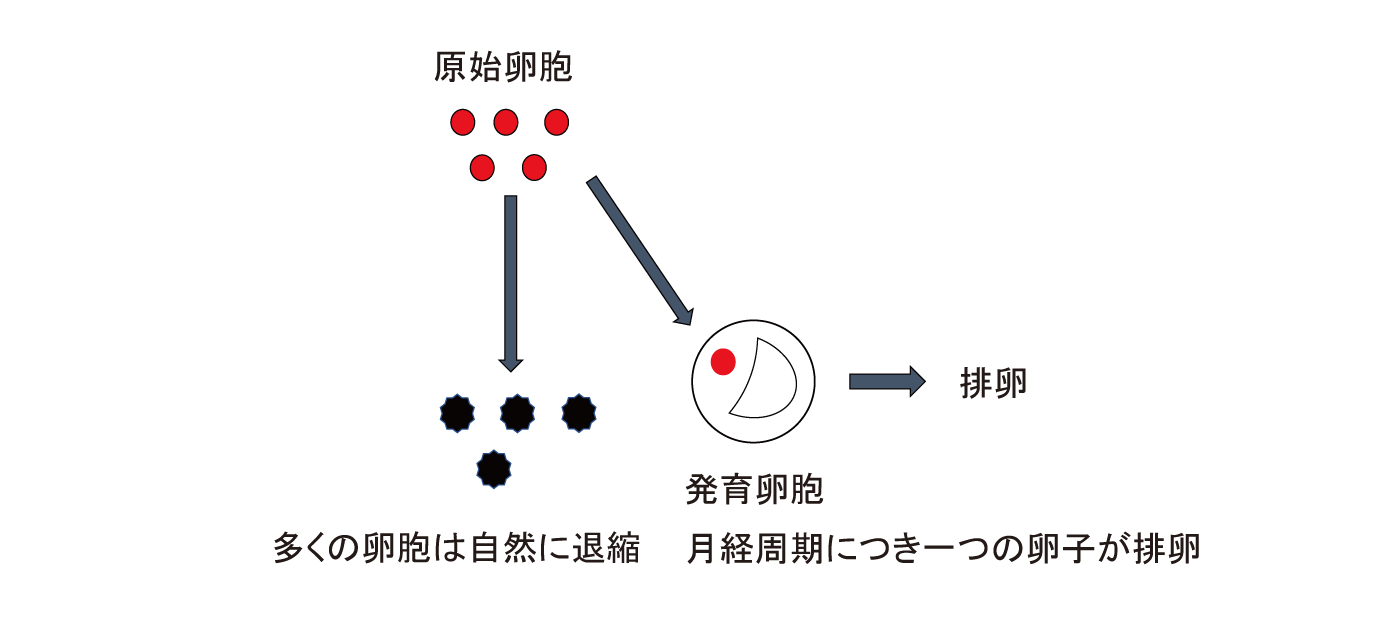
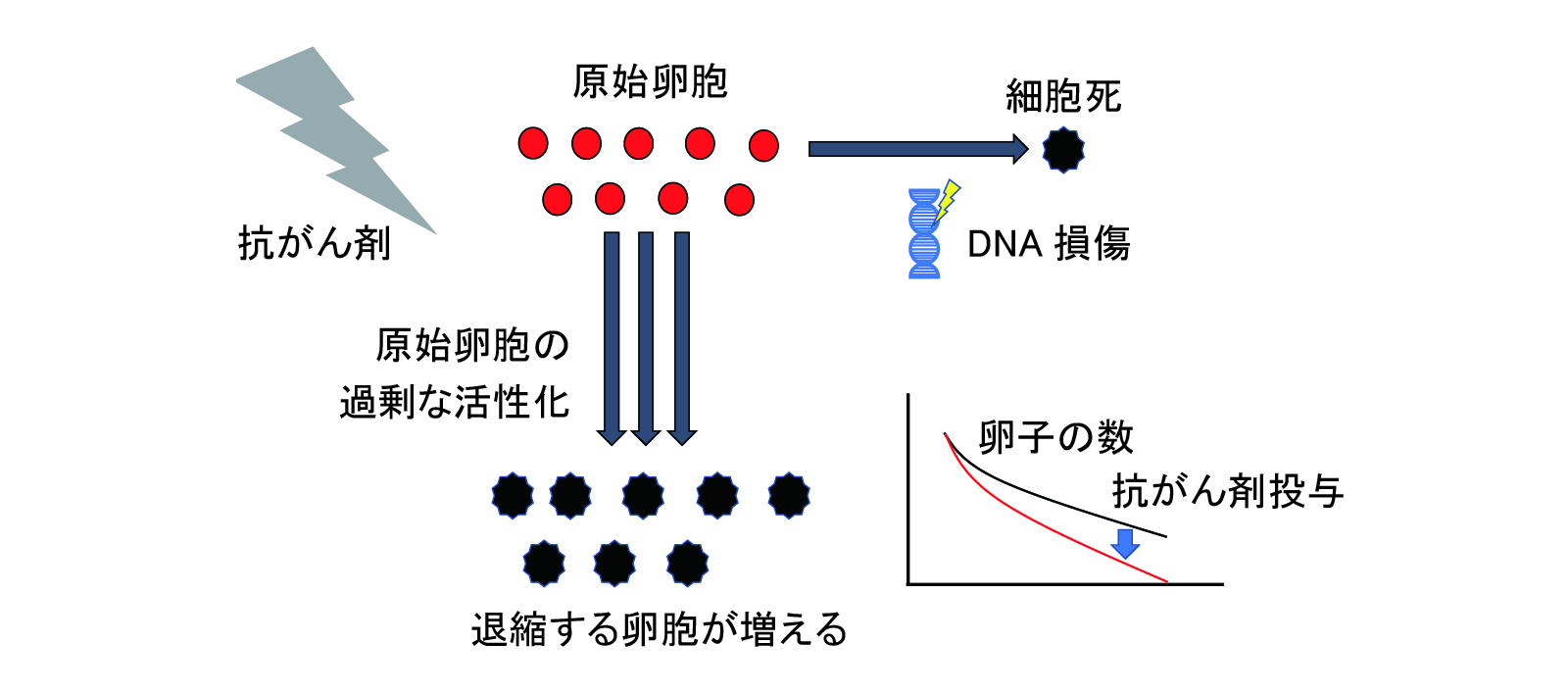
また、もう一つの機序として原始卵胞の活性化が起こり、卵子の枯渇が起こることが知られています。月経周期が確立すると毎月約1,000個の原始卵胞が発育を開始しますが、最終的に排卵に至る卵子はその中の一つで、残りの原始卵胞は発育せず退縮してしまいます(図2)。原始卵胞の活性化は毎月一定数に限られており、大部分の原始卵胞は休眠状態にあります。抗がん剤の投与によって休眠状態にあった原始卵胞が活性化され、通常よりも多くの原始卵胞が消費され、原始卵胞の枯渇をきたし、その結果無月経や閉経に至ると考えられています(図3)。
東京大学医学部 産婦人科
原田 美由紀、高橋 望