妊孕性/妊孕性温存について
女性の方へ
妊孕性温存方法
胚(受精卵)凍結
卵子および胚の凍結保存法として緩慢凍結法とガラス化保存法が挙げられますが、近年ではガラス化保存法が主流となっています。ガラス化保存法は、超急速冷却により細胞内外を原子配列が不規則で結晶構造を取らない非結晶状態に固化(ガラス化)させて低温保存する方法です。ガラス化保存法における凍結・融解で高い生存率を得るためには、細胞内の氷晶形成を防ぐことが必須となります。細胞内の氷晶形成は細胞内体積を増加させ細胞死の原因となるためです。氷晶形成を防ぐためには、凍結過程における細胞内への凍結保護物質(エチレングリコール、ジメチルスルホキシド、スクロース等)の浸透、超急速な冷却、加温が必要となります。
ガラス化保存法の概要として、まず、卵子および胚をガラス化保存液に浸漬することで卵子および胚より脱水、細胞内へ凍結保護物質を置換します。その後、卵子および胚を直ちに液体窒素に投入し、超急速冷却により凍結保存します。一方、融解過程においては、超急速な加温後、卵子または胚を高張液から低張液へ段階的に浸漬することで、漸進的な細胞への覆水および凍結保護物質の除去を行います。
胚のガラス化保存の方法に関しては、様々な製品、プロトコールが存在しますが、その中で最も多く使用されている方法(Cryotop法:北里コーポレーション社)を以下に示します。
胚の凍結融解プロトコール(Cryotop法)
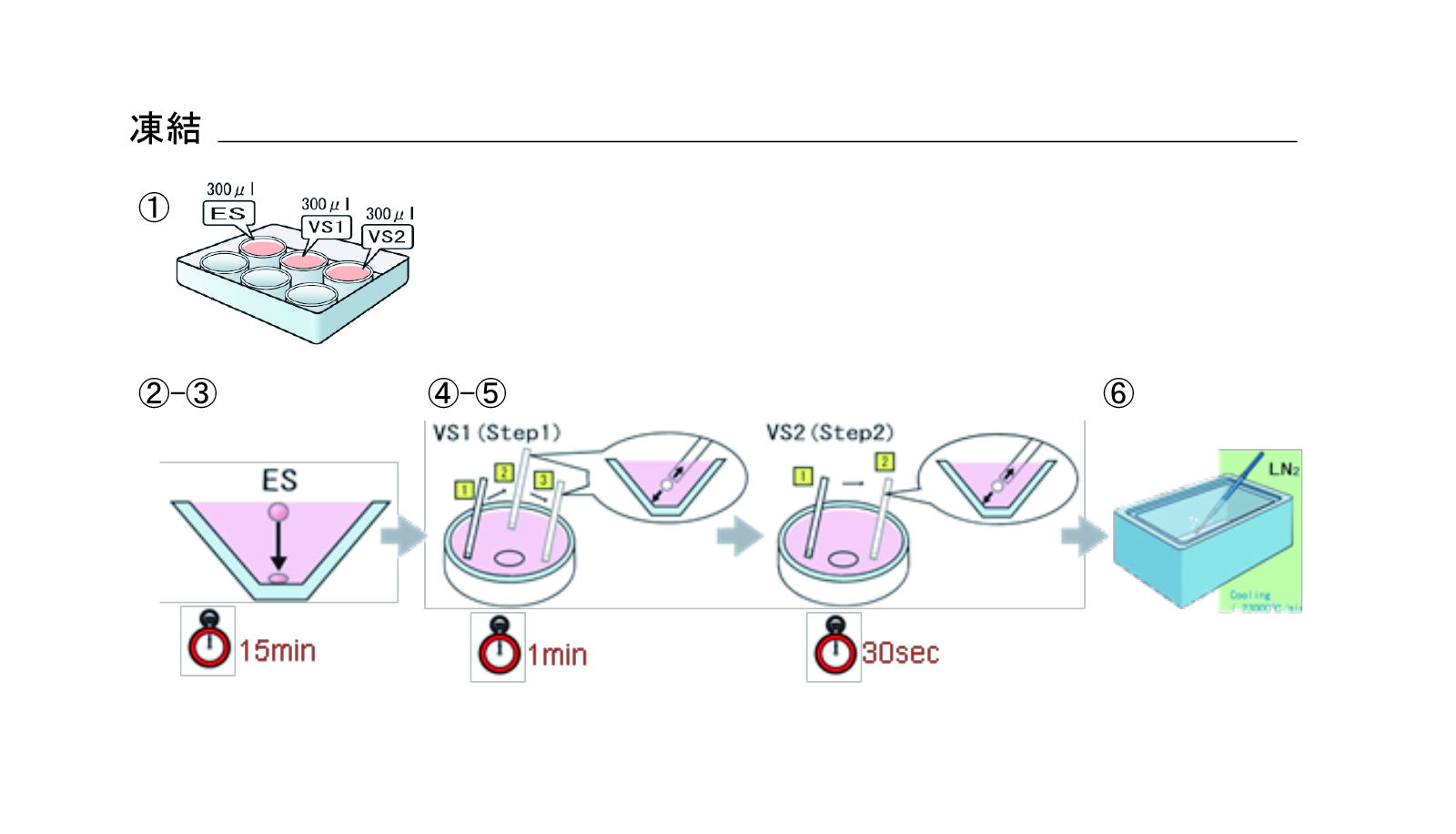
凍結(図3)
- リプロプレートのウェル1にESを300μL、VSをウェル2、3に300μLずつ分注する
- 胚をES液面に移動
- 収縮した胚の体積が回復するのを待つ(処理時間:15分)
- 胚をVS1液面に移動
- VS1で3回洗浄後、胚をVS2に移動させ、2回洗浄(処理時間:VS1 1分、VS2 0.5分)
- Cryotopシート面に胚を乗せ、直ちに液体窒素内に投入する
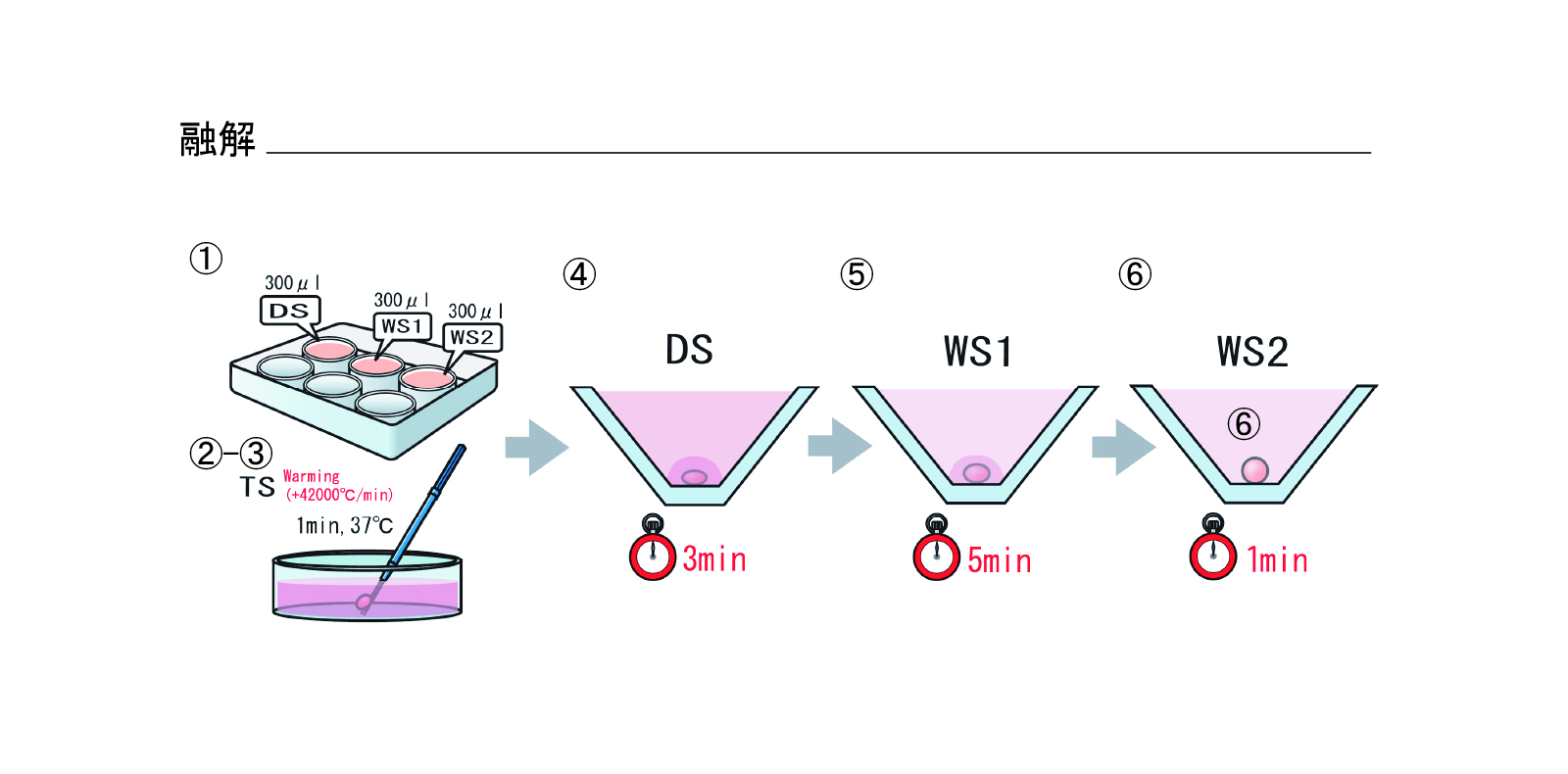
融解(図4)
- リプロプレートのウェル1にDSを300μL、WSをウェル2、3に300μLずつ分注する
- TS液をあらかじめ37℃に加温しておく
- 胚を乗せているCryotop先端を液体窒素からTS液中に1秒以内に移動させる
- TS液で1分間処理
- 胚をTS液からDS液へ移動(処理時間:3分)
- 胚をDS液からWS液へ移動(処理時間:5分)
- 胚をWS2へ移動させ2回洗浄
加藤レディスクリニック
加藤 恵一(藪内)
未受精卵子凍結
胚凍結保存と同様に、卵子凍結保存においてもガラス化保存法が主流となっています。卵子は胚と比較して凍結融解による影響を受け易いとされており、凍結融解を行った卵子は新鮮卵子と比較して受精後の発生能が低い傾向にあります。その要因の一つとして凍結過程における凍結保護物質濃度の急激な変化が卵細胞質に及ぼす影響が挙げられており、卵子凍結保存では凍結過程で凍結保護物質濃度変化を緩和化するプロトコールが用いられています。
卵子凍結保存においても細胞内の氷晶形成は細胞死の原因となるため、凍結過程における細胞内への凍結保護物質の浸透、超急速な冷却、加温が必要となります。 以下に卵子凍結融解(Cryotop法:北里コーポレーション社)のプロトコールを示します。
卵子の凍結融解プロトコール(Cryotop法)
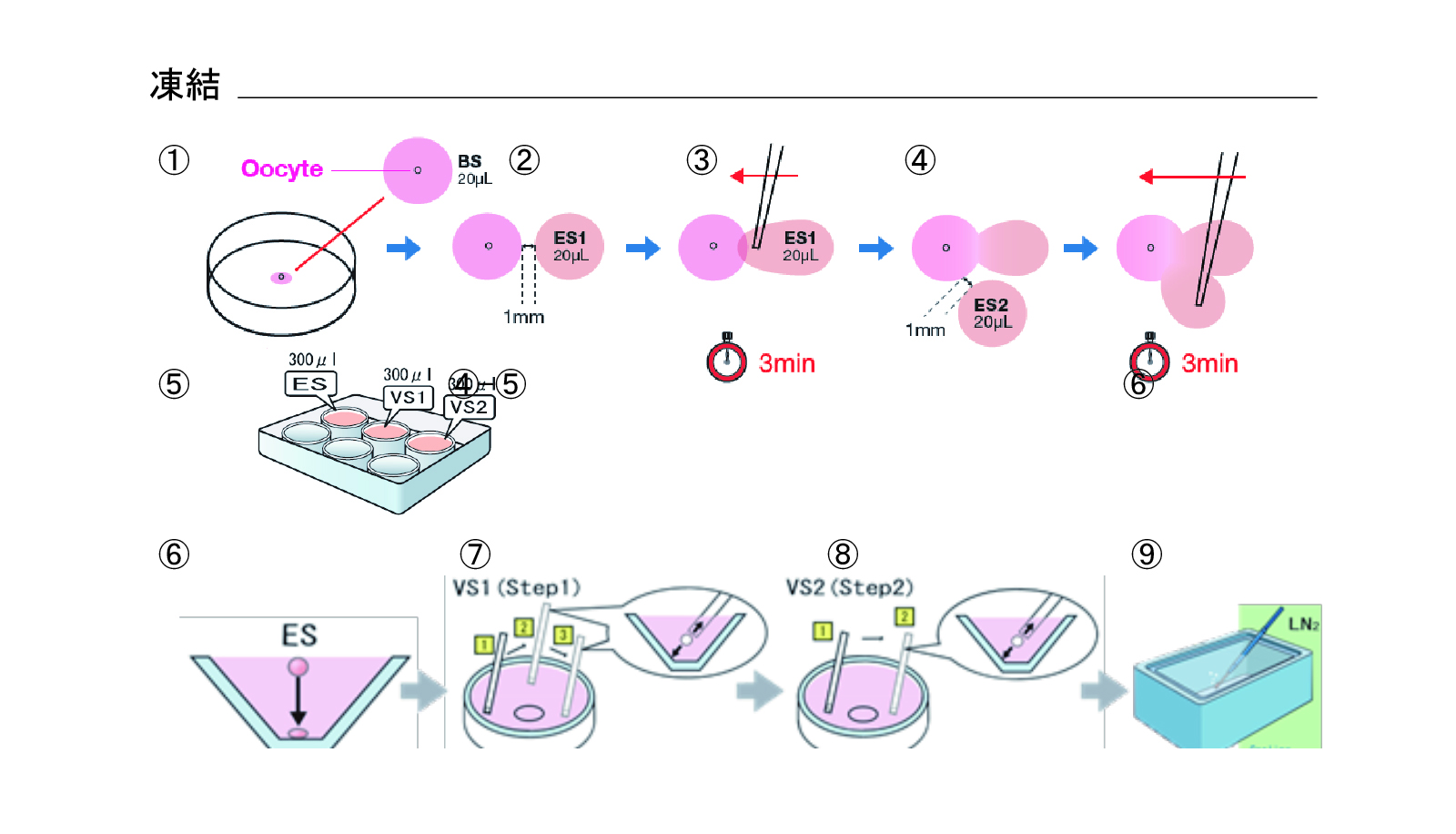
凍結(図5)
- 35mmディッシュ(BDFalcon 351008)の蓋にWSドロップ(20μL)を1個置き、ドロップに卵子を投入する
- WSドロップから1mm離れるようにES1ドロップ(20μL)1個(ES1)を置く
- ES1ドロップの左端にピペット(パスツール)を入れ、そのまま液を左側に引っ張り、WSドロップと合わせ、3分間静置する
- 2分経過後にES2ドロップ(20μL)1個を③のドロップの下に1mm離して置く。ES2ドロップ端からWSへ向かってピペット(パスツール)を動かし③のドロップに合わせ、3分間静置する
- 6wellディッシュにES300μL(ES3)、VS300μLx2(VS1、VS2)を分注する
- ES2ドロップ内にある卵子をパスツールに吸引し、さらに約2mm分のES2を吸引する。6wellディッシュES3の液面に卵子・ES2を移動する。9分間静置する
- 胚をVS1液面に移動
- VS1で3回洗浄後、胚をVS2に移動させ、2回洗浄(処理時間:VS1 1分、VS2 0.5分)
- Cryotopシート面に胚を乗せ、直ちに液体窒素内に投入する
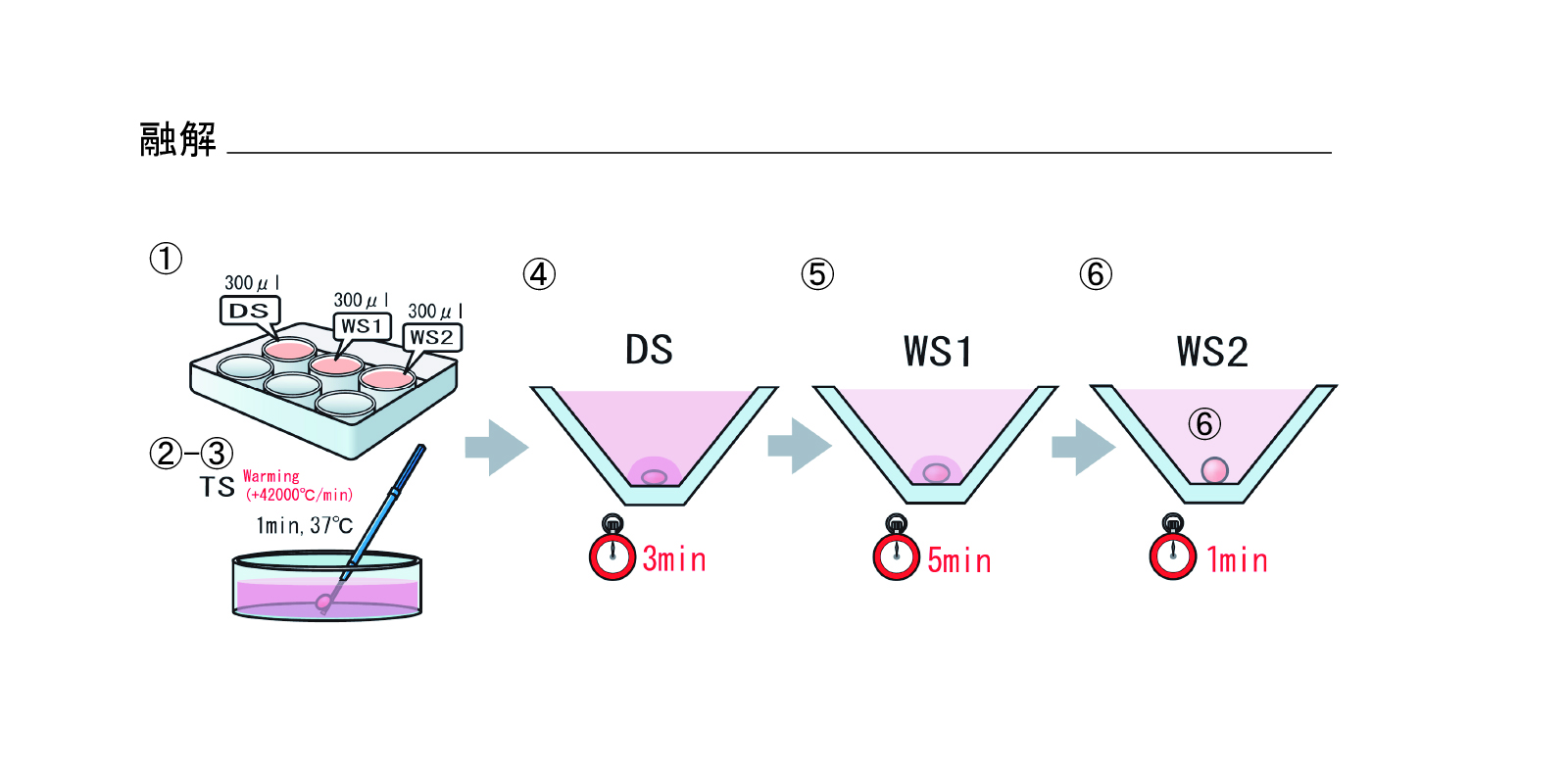
融解(図6)
※融解は胚凍結保存プロトコールと同様です
- リプロプレートのウェル1にDSを300μL、WSをウェル2、3に300μLずつ分注する
- TS液をあらかじめ37℃に加温しておく
- 胚を乗せているCryotop先端を液体窒素からTS液中に1秒以内に移動させる
- TS液で1分間処理
- 胚をTS液からDS液へ移動(処理時間:3分)
- 胚をDS液からWS液へ移動(処理時間:5分)
- 胚をWS2へ移動させ2回洗浄
加藤レディスクリニック
加藤 恵一(藪内)
卵巣組織凍結・自家移植
卵巣摘出から凍結への手順
卵巣組織の凍結および融解後の自家移植は、卵巣機能に影響を及ぼす可能性のある治療を受ける患者さんが治療の開始前に行う妊孕性温存処置のひとつです。
卵巣を手術的に摘出して凍結し、液体窒素中に保存しておきます。手術は開腹術あるいは腹腔鏡手術いずれも適用できますが、体への侵襲性が少ない腹腔鏡手術を適用することが多いです。卵巣を摘出する際には、卵巣の一部を切除して摘出する場合と、卵巣を一括して摘出する場合とあります。卵巣の大きさや患者さんの年齢、臨床経過、あるいはどのような組織処理を行うかなどからどの程度摘出する必要があるか決まりますが、方針・方法は施設により異なります。
摘出した卵巣はクリーンベンチなどの清潔な環境下で処置を行います。卵巣組織は培養液中で余分な組織を切除してトリミングします。卵巣のなかには多くの卵子(原始卵胞)がありますが、それらはほとんど卵巣の外側にあたる皮質が存在しますので、そこの部分に耐凍剤が均等の浸透するようにします。耐凍剤を浸透させたのち、プログラムフリーザーを使用した緩慢凍結法かガラス化法(vitrification法)で凍結させます。凍結させた組織は小さなチューブやプラスチックバックに密封され、液体窒素タンクの中に保管します。
卵巣組織融解から自家移植へ
原疾患の治療が終了した後、妊娠を希望し、凍結させた卵巣組織を使用する必要がある場合には凍結させていた組織を融解します。融解する際には耐凍剤を組織内から漏出させ培養液と平衡化させるような処置を行います。
組織がもとの状態に戻ったら、自家移植を行います。患者さんに移植する場合、もともとあった卵巣(あるいはその近傍)に組織を生着させる方法(同所性移植)と前腕や下腹部の皮下などに生着させる方法(異所性移植)があります。同所性移植では、萎縮して残っている卵巣、あるいは卵巣がない場合は卵管周囲の腹膜の陥凹があるところに貼付、あるいは縫合して生着させますが、そのためには再度手術的処置(腹腔鏡あるいは開腹術)が必要になります。
同所性移植では自然妊娠が期待できます。異所性移植では小手術で済みますが、体外受精が必要になります。その場合卵胞発育が確認しやすい場所に組織を移植すると患者さんの負担が少なくなる可能性があります。ところで、これまでに卵巣組織移植後に妊娠した症例の多くは卵巣あるいはその近傍に移植した患者さんと報告されており、多くの施設では腹腔鏡を用いて同所性移植を選択しています。
卵巣の皮質組織中には、卵胞の最も初期段階で発育を休止している原始卵胞と、その中からすでに発育を開始した発育卵胞があり、発育卵胞には顕微鏡レベルで確認できる段階のものや、直径が10mmを超えて排卵に近い段階のものまで様々な発育段階のものが含まれ、それらの段階によりホルモン活性や感受性が異なります。
また、原始卵胞と発育卵胞では凍結処置などの外的刺激に対する耐性が異なると考えられています。これまでの研究では、卵巣組織中の卵胞は凍結により一部は閉鎖(消失)しますが、適切に凍結できた場合はある程度の原始卵胞の数が維持できると考えられています。一方、融解した組織を腹腔内へ自家移植した場合には、組織が生着するまでに阻血や強い炎症が起こり、多くの原始卵胞が消失すると考えられています。このため、卵巣組織の自家移植を行うためには、凍結前にある程度の卵巣予備能(=原始卵胞数)を維持していることが前提になります。
移植禁忌について
がん患者さんでの卵巣組織の凍結および自家移植では、凍結された卵巣の中にもともとの疾患による悪性細胞の転移や混入がある可能性があります。このため、卵巣に悪性細胞が混入する頻度の高い疾患(白血病など)では移植はリスクを伴いますので、回避しないといけません。この場合、凍結は可能ですが移植は禁忌になります。凍結させた卵巣のなかには原始卵胞がありますので、これをリスクなく妊娠に向けて使用できるように現在研究が行われています。
長崎大学医学部 産婦人科
北島 道夫
女性の妊孕性温存とIVM治療
はじめに
近年、成人女性の癌患者罹患率は増加傾向を示していますが、手術療法や化学療法などの治療成績は向上し、がん患者の生存率も改善しています。その中で乳癌の罹患率が最も高く、年間9万人以上の患者が新たに乳癌を発症しています。しかし、治療によりこれらの原疾患は改善されますが、その後妊孕性の消失が問題となり、抗がん剤による卵巣の細胞障害は時に永続的な卵巣機能不全を引き起こします。この妊孕性喪失の高リスク群は放射線療法、骨髄移植のための化学療法、特にアルキル化剤を含む化学療法施行例に見られます。女性の場合、乳癌患者も含めて生殖補助技術(ART)を用いた孕性温存治療には卵子凍結、受精卵凍結、卵巣凍結が考えられますが、どの方法を用いるかは癌の種類、進行程度、抗がん剤の種類、年齢、結婚の有無などによって選択されます。
IVMは妊娠率の上昇と共にARTにも取り入れられ、我々はその有用性と安全性を報告しました1)2)。 更にIVMではヒト癌患者特に女性ホルモンを抑制する必要とする乳がん患者が適応となり、海外でもこの方法が広く用いられています3)。更に若年がん患者においては卵巣組織凍結が持に用いられますが、この際にも採取された組織より卵子を抽出する際の技術にIVMの技術が応用されています。
今回我々は過去のIVMとその改善点にふれ、女性ホルモンの上昇を抑えられるIVMの使用法の実際とその妊孕性の改善点について報告します。
癌患者のIVMの適応と応用
IVMはがん患者特に女性ホルモンに影響されやすい乳癌患者やその他の女性ホルモン依存性の癌が適応となります。更に若年性がん患者には卵巣組織が行われ、2004年にベルギーのDoonezによりヒトで初めて生児獲得の報告がありました。欧米ではその後、4000例以上の癌凍結例が報告されています。思春期前の女子に有用と言われていますが、癌の種類によっては卵巣に転移する可能性のある白血病や卵巣癌などは適応とならない場合があり、慎重に対応する必要があります。更に癌患者へのdonationにOHSSのriskの少ないIVMを利用して提供卵としている報告があります。
癌化学療法と妊孕性温存
癌化学療法により誘発される卵巣機能低下は化学療法後1年以内に生じやすく、発症率は20~100%と言われています。発生頻度は患者の年齢、進行度、化学療法の種類等に依存し4)、Larsenらは化学療法の年齢が重要となり、思春期の癌患者では早発閉経となる確率が4倍も高まると報告しています5)。更にサイクロフォスファマイド等のアルキル化剤は2006年のASCOの化学療法別の卵巣機能不全のリスク報告で最も影響が大きいと乳腺外科の阪口らの報告にも掲載されています6)。
現在、妊孕性温存の手技としてARTを利用した卵子・精子凍結、受精卵凍結、卵巣・精巣の凍結等があります。ASCOガイドラインでは最適な妊孕性温存方法を選択するため、癌の種類、進行度、化学療法薬剤の種類等を考慮する必要がいるとされています7)。
当院におけるIVMの実際と成績
2007年4月から2018年4月までの間にIVMを施行した113例159周期を対象とし、患者年齢は31.8±4.1歳、採卵決定時E2値は504±425(pg/ml)でした(表1)。平均採卵数7.3±4.1個、成熟率59.6%、受精率72.6%、分割率95.9%、胚盤胞率は36.2%です。不妊患者でのIVMでの胚移植あたり妊娠率は全体で26.8%でしたが、最近では約30~40%と改善しています(表1)。
1)採卵と吸引法
月経周期7日目頃より経膣超音波にてモニターを開始し、採卵の時期は卵胞径が8~10mmで2個以上確認できた時としました。採卵時の培養液はHepes HTFにヘパリン20IU/mlを添加したものを使用し、Single needle(17G先端20Gヴィトロライフ)を使用し、吸引圧は60-80mmHg前後に設定しました。
2)培養及び顕微授精
採卵された卵子は顆粒膜細胞と一緒に培養し、成熟培養液は市販のIVM培養液に20%の患者血清を添加しています。成熟卵にICSI施術24時間後に前核を確認し、受精した卵を培養し、分割卵や胚盤胞まで培養して移植に用います。
3)癌治療後の胚移植及び黄体の管理
癌治療終了後生存した癌患者の胚移植は、通常、卵巣機能が低下していることが多いため無月経となり、子宮内膜が菲薄で胚移植が困難な事が多くなります。このためカウフマン療法により3~6か月のホルモン投与により正常の子宮内膜を賦活させる必要がいる場合が多くなります。胚移植後の黄体管理は、凍結融解胚移植と同様にエストロゲン剤、経膣的プロゲホルモン膣座薬を使用しました。
考察
成人女性の乳癌は女性ホルモン依存性細胞の陽性率が高く、誘発には女性ホルモン値(E2)の上昇を避けるため、アロマターゼ阻害薬を用いE2の上昇を抑制する方法が最近用いられるようになりました。IVMでは更にE2上昇が抑えられ、カナダのMcGill大学やデンマークなど欧米では乳がん患者の妊孕性温存にはIVMをE2抑制の観点から積極的に取り入れています3)。
2003年にASCO(米国腫瘍学会) とASRMの共同で癌患者における妊孕性温存関するガイドラインが出され、2006年にアップデートされました7)。
わが国では厚生労働省の「小児・若年がん長期生存者に対する妊孕性のエビデンスと生殖医療ネットワーク構築に関する研究」班が若年がん患者などの性腺機能と妊孕性、妊娠出産に関する情報を提供し8)、乳癌患者においては乳がん患者の妊娠出産と生殖医療に関する診療の手引き(2014年版)9)を刊行しています。 そこでは生殖医療専門医と乳癌専門医の連携を重視し、癌化学療法による妊孕性の低下と恒久的な喪失の可能性等6項目を癌治療決定前に乳癌専門医から患者へ知らせるべきとしています。
IVMは癌患者の妊孕性温存に必要とされていますが、Ubaldiらは凍結未授精卵子での累積妊娠率は41歳以上で低下し10)、Oktayらは卵巣凍結の適応は40歳未満としています11)。癌化学療法後の自然妊娠や出産は乳癌の再発、死亡リスクを高めるものではないと報告されていますが12)、ARTでの排卵誘発剤がホルモンレセプター陽性乳癌に及ぼす影響についての安全性はいまだ確立されておらず、今後検討が必要です。化学療法時のGnRha使用は2013年のASCOのガイドラインでは十分なビデンスがなく、化学療法の際にその併用は慎重にすべきとしています。
女性乳癌の70%はHormone Receptor 陽性であり、術後タモキシフェンなどのホルモン療法が標準治療となっています14)。しかし、タモキシフェンは動物実験において催奇性が報告され15)、投与中の妊娠を回避すべきです。代謝産物が完全に排出されるまでのクリーンオフに2~3か月を要する点も考慮する必要があります。
IVM卵の成熟に関しては核の成熟が速く、細胞質の成熟とのアンバランスによりその後の胚発育への影響が出現すると言われています。PCOでは顆粒膜細胞の豊富な卵子の回収がポイントです16)。
近年、ART児でのepigenetisに問題が発生し、Angelman Syndrome等が注目され、IVM児にも何らかの異常をきたす可能性があるため、我々は東北大学の有馬らと共同研究し、出生した児の胎盤や臍帯血に異常がない事を報告しました16) 。しかしながら今後、癌患者より得られた卵子などの長期予後と更なる症例数の検討が不可欠と考えられており、より安全な医療と技術の開発が求められています。
おわりに
IVMは癌患者の妊孕性温存治療として特にエストロゲン依存性の乳癌等には有用で、実際に欧米では若年癌患者にも応用されています。その上、手術や化学療法による治療の進歩により、生存可能となっている癌患者治療後のQOLを考慮し、安全性と質の高い妊孕性温存のために更なる癌患者へのIVMの検討が必要です。
仙台ARTクリニック
吉田仁秋、山田健市、菊地裕幸、品川真澄、片桐未希子
表 IVM臨床の背景および培養成績
| IVM培養成績 | |
|---|---|
| 期間 | 2007.4~2018.10 |
| 症例周期数 | 113症例159周期 |
| 患者年齢(歳) | 31.8±4.1 |
| FSH総投与量(IU) | 572±212 |
| 採卵決定時E2値(pg/ml) | 504±425 |
| 採卵日(日) | 12.3±1.5 |
| HCG投与(%) | 96.4 |
| 採卵数(個) | 7.3±4.1 |
| 成熟率(%) | 59.6(672/1127) |
| 受精率(%) | 72.6(488/672) |
| 分割率(%) | 95.9(468/488) |
| Day3良好胚率(%) | 40.9(200/488) |
| Total Blasto率(%) | 36.2(92/254) |
| 良好Blasto率(%) | 12.9(33/254) |
引用文献
- 吉田仁秋: IVM(未成熟卵子体外培養による体外受精)の実際, 産婦人科の実際, 特集不妊治療ハンドブック, 第58巻, 第11号: 2009
- 吉田仁秋:エキスパートに学ぶー体外受精実践講座 :未熟卵子の体外培養, 臨産婦62巻7号962-967, 2008
- Zhi-Yong, Yang, Ri-Cheng Chian , Development of if in vitro maturation techniques for clinical applications : Fetil & Steril Oct.; 084(4);577-584, 2017
- Bines J, Oleske DM, cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 1996; 14: 1718-1729.
- Larsen EC, Muller J, Schmiegelow K, Rechnitzer C, Andersen AN. Reduced ovarian function in long-term survivors of radiation- and chemotherapy-treated childhood cancer. The journal of clinical endocrinologyand metabolism 2003; 88: 5307-5314.
- 阪口晃一,田口哲也:特集「生殖医療の進歩と小児および若年成人癌患者への適応」乳がん治療における妊孕性温存:京都府立医大誌126(8),547-554, 2017
- Lee SJ, Schover LR, Partridge AH, Patrizio P, Brennan LV, Oktay K, American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. Journal of clinical oncology: official journal of the American Society of clinical Oncology 2006; 24: 2917-2931
- 厚生労働科学研究費補助金がん対策推進総合研究事業「小児・若年がん長期生存者に対する妊孕性のエビデンスと生殖医療ネットワーク構築に関する研究」班. 小児・若年がん長期生存者に対する妊孕性のエビデンスと生殖医療ネットワークに関する研究.
- 乳癌患者の妊孕性保持のための治療選択患者支援プログラム関係ガイドラインの開発班. 乳がん患者の妊娠出産と生殖医療に関する診療の手続き 2014.
- Ubaldi F, Anniballo R, Romano S, Baroni E, Albricci L, Colamaria S, Capalbo A, Sapienza F, Vajta G, Rienzi L. Cumulative ongoing pregnancy rate achieved with oocyte vitrification and cleavage stage transfer without embryo selection in a standard infertility program. Hum Reprod 2010; 25: 1199-1205.
- Oktay K. Evidence for limiting ovarian tissue harvesting for the purpose of transplantation to women younger than 40 years of age. The journal of clinical endocrinology and metabolism 2002; 87: 1907-1908.
- Azim HA, Jr., Kroman N, Paesmans M, Gelber S, Rotmensz N, Ameye L, De Mattos-Arruda L, Pistilli B, Pinto A, Jensen MB, Cordoba O, de Azambuja E, Goldhirsch A, Piccart MJ, Peccatori FA. Prognostic impact of pregnancy after breast cancer according to estrogen receptor status: a multicenter retrospective study. Journal of clinical oncology: official journal of the American Society of Clinical Oncology 2013; 31: 73-79.
- Blumenfeld Z, Avivi I, Linn S, Epelbaum R, Ben-Shahar M, Haim N. Prevention of irreversible chemotherapy-induced ovarian damage in young women with lymphoma by a gonadotrophin-releasing hormone agonist in parallel to chemotherapy. Hum Reprod 1996; 11: 1620-1626.
- Early Breast Cancer Trialists’ Collaborative G. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an over view of the randomized trials. Lancet 2005; 365: 1687-1717.
- Barthelmes L, Gateley CA. Tamoxifen and pregnancy. Breast 2004; 13: 446-451.
- H. Yoshida, H. Abe, T. Arima: Quality evaluation of IVM embryo and imprinting genes of IVM babies, Journal of Assisted Reprod. Genet.: 30:221, 2013




